Synligt rent: Klarhed over de lovmæssige vejledninger
Af Thomas Altmann, Global CIP/COP Teknisk Manager Rengøringsvalidering

Synligt rent er en betegnelse, der bruges i næsten alle farmaceutiske reguleringer (FDA, PI C/S, GMP). Enkelt sagt skal udstyr, som bruges i fremstillingen af lægemidler inspiceres for synlig renlighed før de tages i brug1.
Det giver mening - men nogle få har en 100 % idé om, hvad synligt rent betyder i standardprocedurer og, hvordan man dokumenterer validering af rengøring. De oftest stillede spørgsmål inkluderer:
- Hvordan ser restkoncentrationer ud?
- Hvor er grænserne for synlighed?
- Hvordan påvirker konstruktionsmaterialet synligheden?
- Hvor ofte skal en inspektørs syn testes?
Herunder finder du en diskussion af disse problemstillinger.
Hvordan ser restkoncentrationer ud?
Dine inspektører er nødt til at vide, hvad de skal se efter, når de inspicerer udstyret. De bør være i stand til at se forskel på restkoncentrationer fra processen og overskydende restkoncentrationer fra desinfektionsprodukter - og hvordan lave niveauer af de forskellige typer restkoncentration kan forekomme. Dertil må inspektørerne have viden om, hvordan den synligt rene overflade ser ud, inklusiv stålets farvetone, ridser eller andre skader, der ikke har indflydelse på næste trin i produktionen.
Aktive farmaceutiske ingredienser (API) fx kommer til syne som pulver, og restkoncentrationer fra desinfektionsmidler kan ses som pletter på overfladen.

API-restkoncentrationer kommer ofte til syne som pulver.

Restkoncentrationer fra desinfektionsmidler kan ofte ses som pletter.
Restkoncentrationer fra desinfektionsmidler bliver ofte overset af "synligt rent" inspektører. Producenter af medicin der bruger rengøringsmidler, der er designet til mad og drikke-applikationer bør være klar over at restkoncentrationer af ikke-vand-opløselige ingredienser som rustbeskyttelsesmiddel eller særlige rensemidler kan forblive og der kan opstå en uventet interaktion med restkoncentrationer af API'er som kan finde vej til de produkter, der fremstilles efterfølgende.
Hvordan påvirker konstruktionsmaterialet fremkomsten?
Restkoncentrationer kan komme til syne på forskellig vis alt afhængigt af, hvilket materiale der er blevet brugt under fremstillingen af det udstyr der inspiceres. Omkring 90 % af udstyret der bruges i fremstillingen af medicin er lavet af rustfrit stål - med glas, gummi og polymer, såsom Teflon og EPDM, der står for størstedelen af resterne.
En overvejelse man bør gøre sig under udvælgelsen af udstyr og uddannelsen af inspektører er at det er sværere at spotte restkoncentrationer på polymer-overflader end det er at spotte restkoncentrationer på udstyr, der er fremstillet i rustfrit stål.
Når det er sagt kan/vil udstyr i rustfrit stål, der bliver udsat for høj varme blive misfarvet over tid - hvilket gør det sværere at identificere restkoncentrationer, end da udstyret blev leveret. Ethvert udstyrs overflade som ridses er nødt til at blive genpoleret (om muligt) eller byttet ud, så snart man ikke længere kan verificere synlig renhed.

Inspektørerne skal uddannes i at kunne spotte, hvordan hver enkelt type restkoncentration kommer til syne på forskellige typer af overflader.

Tilsynekomsten af restkoncentrationer kan få indflydelse på forskellige materialers finish (rustfrit stål kontra Teflon eller nyt/poleret kontra misfarvet rustfrit stål.
Hvor er grænserne for synlighed?
Den visuelle grænseværdi er koncentrationsniveauet, når en API eller restkoncentration bliver synlig. Producenter er nødt til at fastslå den visuelle grænseværdi for hver enkelt API eller restkoncentration - og så sammenligne med niveauer, når samme API eller restkoncentration bliver toksikologisk signifikant. Hvis den synlige grænseværdi er lavere end det forhåndsbestemte toxikologiske signifikansniveau for den pågældende API eller rengøringsrestkoncentration, så er synligt ren en valid størrelse.
Analysen herunder viser koncentrationen ved hvilken Paracetamol (en API med relativ lav risiko) bliver synlig.
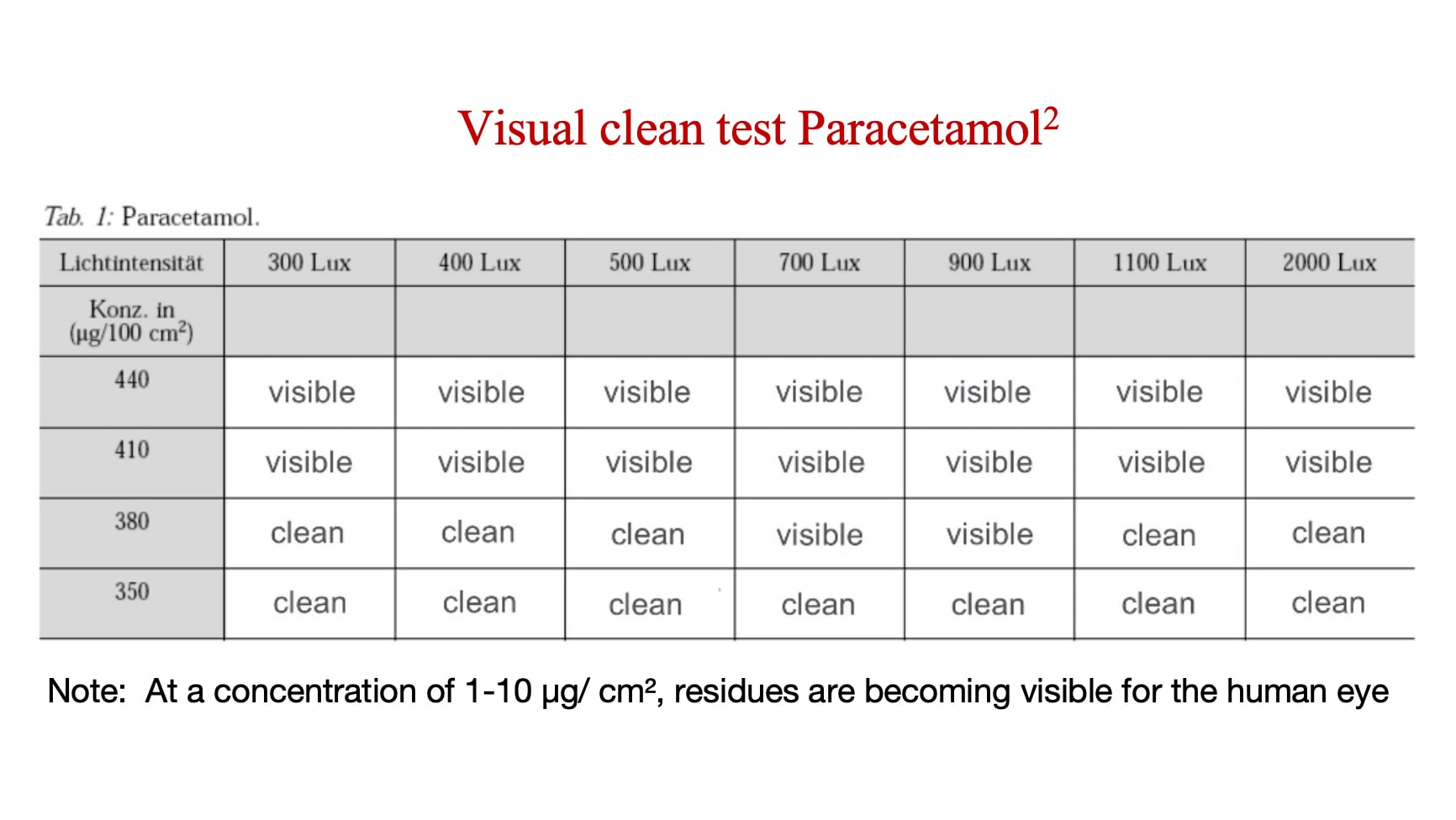
Hvor ofte skal en inspektørs syn testes?
Igen må vi sige at vejledningerne ikke er specifikke. Mange virksomheder kræver nu, at alle operatører, der udfører visuelle inspektioner er nødt til at få foretaget en øjenundersøgelse en gang om året.
Det er ikke påkrævet ved lov. Hvis der på den anden side bliver sat spørgsmålstegn ved dine rengøringsprocedurer er du godt stillet i forhold til at overbevise myndighederne om at du har gjort hvad du kunne, hvis du løbende har dokumenteret, at du har uddannet dine inspektører grundigt og eksamineret deres syn med jævne mellemrum.
Yderligere spørgsmål?
Kontakt Ecolab Life Sciences for at få mere information om bedst praksis og retningslinjer for synligt ren. Vi er tilstede på farmaceutiske anlæg over hele verden og har indsigt i, hvordan producenterne implementerer synligt ren i deres rengøringsvalideringsprogrammer.
1FDA - 21 CFR Part 211.67 påkrævet under punkt (6) inspektion af udstyr til sikring af renlighed før anvendelse
2Farm. Ind. 62, Nr. 6 (2000) Buscalferri et al. - Rengøringsvalidering


