En gennemgang af effektivitetstest af desinfektionsmidler – relevansen af en vådkontakt-tid

Indledning
Brugen af desinfektionsmidler til kontrol af mikrobiologisk smitte af et miljø er velbeskrevet og underlagt myndigheder i både Europa og USA.
Biocidal Products Regulation (BPR) 528/2012 [1] dækker markedsføring og brug af biocidholdige produkter i Europa. Kemiske desinfektionsmidler i USA er registreret og reguleret af US Environmental Protection Agency (EPA) under Federal Insecticide, Fungicide, and Rodenticide Act (FIFRA) (40 CFR Parts 150-189) [2]. Under FIFRA betragtes kemiske desinfektionsmidler som "antimikrobielle pesticider".
Data, der beskriver effektiviteten af et desinfektionsmiddel, uanset om det er bakterie-, svampe-, spore- eller virusdræbende, er et klart krav fra BPR eller EPA for at en producent af desinfektionsmidler kan opnå registrering.
For slutbrugere af desinfektionsmidler inden for medicinalsektoren angiver reglerne også behovet for, at de skal demonstrere desinfektionseffekt. Vejledningen fra FDA (USA's fødevare- og lægemiddelforvaltning) til medicinalindustrien siger: "Egnetheden, effektiviteten og begrænsningerne af desinfektionsmidler og -procedurer bør vurderes. Effektiviteten af disse desinfektionsmidler og procedurer bør måles i forhold til deres evne til at sikre, at potentielle kontaminanter fjernes tilstrækkeligt fra overflader" [3]. I Europa stilles lignende krav til rådighed af Europa Kommissionen, "4.37 Desinfektionsprocessen bør valideres. Valideringsundersøgelser skal påvise desinfektionsmidlers egnethed og effektivitet på den specifikke måde, hvorpå de anvendes, og bør understøtte udløbsperioderne ved brug af forberedte løsninger."4
Metoder til at demonstrere effektivitet
I Europa giver European Norm (EN) standard 14885:2018 [5] referencer til påkrævede testmetoder (EN-standarder), der skal bruges af producenter af desinfektionsmiddel til at understøtte påstande om mikrobiocid aktivitet. I USA beskriver EPA Product Performance Test Guideline OCSPP 810.2100 [6] de testmetoder (Association of Official Analytical Chemists (AOAC) metoder), der skal bruges af producenter af desinfektionsmiddel til at understøtte påstande om mikrobiocid aktivitet.
Testtyperne kan inddeles i to kategorier:
- Suspensionstest
f.eks. EN 1276 Kemiske desinfektionsmidler og antiseptiske midler. Kvantitativ suspensionstest til evaluering af bakteriedræbende aktivitet af kemiske desinfektionsmidler og antiseptiske midler, der anvendes i fødevarer, industri, husholdninger og institutioner. Testmetode og krav (fase 2, trin 1).
f.eks EN 1650 Kemiske desinfektionsmidler og antiseptiske midler. Kvantitativ suspensionstest til evaluering af svampedræbende aktivitet af kemiske desinfektionsmidler og antiseptiske midler, der anvendes i fødevarer, industri, husholdninger og institutioner. Testmetode og krav (fase 2, trin 1).
AOAC officielle metode 955.15 Test af desinfektionsmidler mod Staphylococcus aureus, brug af fortyndingsmetode.
- Overfladetest
f.eks. EN 13697 Kemiske desinfektionsmidler og antiseptiske midler – Kvantitativ ikke-porøs overfladetest til evaluering af bakteriedræbende og/eller svampedræbende aktivitet af kemiske desinfektionsmidler, der anvendes i fødevarer, industri, husholdnings- og institutionelle områder – Testmetode og krav uden mekanisk virkning (fase 2, trin 2).
AOAC officielle metode 961.02 bakteriedræbende sprayprodukter som desinfektionsmidler.
De forskellige testmetoder bruger specifikt startpodestof, organismer, logreduktioner og kontakttider.
For at fremsætte påstande om desinfektionsmidler i Europa, udfører producenter af desinfektionsmidler normalt EN-testene, og EN-testnumrene kan være angivet på produktetiketterne sammen med standardkontakttider, der er angivet i metoden. Standardtestmetoderne bruges normalt, da de er robuste, reproducerbare og velkendte. Det kan også være nyttigt for slutbrugere at kunne referere til resultater fra standardmetodetests for at sætte dem i stand til at sammenligne produkter fra forskellige producenter.
For en slutbruger af et desinfektionsmiddel afspejler standardtestmetoderne muligvis ikke forholdene i deres eget farmaceutiske renrum. Slutbrugere vil typisk have forskellige overfladematerialer i deres renrum, forskellige mikroorganismer til stede og forskellige miljøforhold (såsom lav luftfugtighed, hurtig tørring på grund af HVAC-systemer).
The United States Pharmacopoeia (USP)-kapitlet <1072>[7] giver yderligere råd om effektivitetstestning for den farmaceutiske sektor, og fremsætter: "For at demonstrere effektiviteten af et desinfektionsmiddel i et farmaceutisk produktionsmiljø, kan det anses for nødvendigt at udføre følgende test: (1) brug fortyndingstest (screening af desinfektionsmidler for deres effektivitet ved forskellige koncentrationer og kontakttider mod en lang række standardtestorganismer og miljøisolater) (2) Overfladetest af desinfektionsmiddel (ved anvendelse af standardtestmikroorganismer og mikroorganismer, der er typiske miljøisolater ved påføring af desinfektionsmidler på overflader med den valgte brugskoncentration med en specificeret kontakttid og bestemmelse af logreduktionen af testmikroorganismerne); og (3) en statistisk sammenligning af hyppigheden af isolering af mikroorganismer isoleret før og efter implementeringen af et nyt desinfektionsmiddel.
Dette anses for nødvendigt, fordi kritiske procestrin som desinfektion af aseptiske behandlingsområder, som krævet af GMP-reglerne, skal valideres, og EPA-registreringskravene omhandler ikke, hvordan desinfektionsmidler faktisk bruges i de farmaceutiske, bioteknologiske og medicinske udstyrsindustrier.
I overensstemmelse med USP-vejledningen er det relativt nemt at anvende forskellige mikroorganismer og testoverflader med standardtestmetoder. Det kan dog være en udfordring at opnå de specificerede kontakttider for standardtestmetoderne inden for miljøforholdene i et farmaceutisk renrum. Fordampningshastigheden af et desinfektionsmiddel, der smøres på en overflade i et renrum med en høj grad af luftudskiftning, kan være væsentligt anderledes end fordampningshastigheden under laboratorieforhold. Dette rejser spørgsmål om, hvorvidt overfladen skal være synligt fugtig af desinfektionsmiddel i det angivne tidsrum for at opnå effekt, og derfor præcist hvad forventningen til en kontakttid er.
Definitioner af kontakttid
For at fastslå, om det er et lovkrav i den farmaceutiske sektor, at overflader skal forblive synligt våde i hele kontakttiden (herefter benævnt "våd kontakttid"), blev der foretaget en gennemgang af reglerne.
Retningslinjer fra US [3],[8], EU GMP [4] og Pharmaceutical Inspection Co-operation Scheme [9] definerer ikke 'kontakttid'. Den Europæiske Farmakopé (EP) giver ingen vejledning om test af desinfektionsmidlers effektivitet. I modsætning hertil bruger USP-kapitlet 1072 [7] udtrykket 'kontakttid' ofte, men beskriver ikke i detaljer dets betydning i definitionssektionen i kapitlet. ISO-standarden for renrum (ISO 14644 del 5 [10]) giver heller ikke nogen definition.
Da den farmaceutiske sektors regler ikke giver en klar betydning, blev der foretaget en bredere søgning i andre gældende lovmæssige dokumenter og anerkendte vejledninger for den farmaceutiske industri.
Royal Pharmaceutical Society/NHS Pharmaceutical Quality Assurance Committee giver vejledning om anvendelsen af desinfektionsmidler, med angivelse af "Samling af overskydende mængder af rengørings- og desinfektionsmidler bør undgås. Ideelt set skal overflader være tørre inden for 1 time efter påføring. Omvendt bør der forblive tilstrækkeligt med produkt til at opnå den påkrævede effekt i hele den anbefalede kontakttid, dvs. desinfektionsmidler bør ikke spredes for tyndt" [11]. Denne erklæring udleder en forventning om, at der kræves en våd kontakttid for at opnå effektivitet.
EN- og AOAC-metoderne angiver ikke en "våd kontakttid". I suspensionstests bruges altid en 'våd kontakttid', da testen involverer tilsætning af desinfektionsproduktet til en organismesuspension, der holdes i opløsning i den påkrævede kontakttid, med produktneutralisator tilsat ved slutningen af denne kontakttid.
Det er dog ikke så tydeligt for overfladetest, da en mængde desinfektionsmiddel, som defineret af standarden, pipetteres på overfladen uden at sprede det ud. På grund af de små mængder, der pipetteres, og den relativt høje overfladespænding af de fleste testede desinfektionsmidler, er det sandsynligt, at en våd kontakttid vil blive opnået under laboratorieforhold.
EN-overfladetesten med mekanisk virkning, EN 16615 [12], giver den testmetode, der er tættest på den praktiske brug af desinfektionsmidler, fordi den inkorporerer virkningen af at smøre desinfektionsmidlet på en overflade. Under afsnittet Forsøgsbetingelser gives følgende oplysninger om kontakttid: "Kontakttiderne for overfladedesinfektionsmidler vælges på baggrund af produktets praktiske forhold. Den anbefalede kontakttid for brugen af produktet er inden for producentens ansvar." Det kunne udledes af formuleringen "produktets praktiske forhold", at de henviser til mængder, der påføres med moppe eller servietter og fordampningshastigheder, for eksempel en alkohol sammenlignet med en kvaternær ammoniumforbindelse, men igen er dette ikke en klar definition.
The Pharmaceutical and Healthcare Sciences Society (PHSS) Technical Monograph 20 giver følgende oplysninger under afsnit 3.3.4 "Kuponerne er udsat for desinfektionsmiddel i den definerede våde/opholdsmæssige kontakttid" [13]. Dette er et klart udsagn om, at kontakttiden er våd.
Det amerikanske Center for Disease Control and Prevention (CDC)'s retningslinjer [14] giver følgende ordlistedefinition af kontakttid: "Tid, hvor et desinfektionsmiddel er i direkte kontakt med overfladen eller emnet, der skal desinficeres. Til overfladedesinfektion er denne periode indrammet af påføring på overfladen, indtil fuldstændig tørring er sket." Denne definition angiver også klart en våd kontakttid.
Product Performance Test Guideline, OCSPP 810.2000 [15], giver følgende oplysninger om kontakttid: "Kontakttiden, der bruges i effektivitetstestning, bør være den samme eller kortere end den kontakttid, der er angivet på produktetiketten. Hvis en kontakttid er forskellig fra det interval, der er identificeret i testmetoden, eller retningslinje foretrækkes, anbefales det at konsultere agenturet før testning, og en ændring af standardmetoden kan være nødvendig. I de fleste tilfælde er en ændring for at give en længere eksponeringsperiode begrænset af de praktiske overvejelser af brugsmønstrene (f.eks. en eksponeringsperiode på >10 min. for et produkt, der sandsynligvis vil fordampe fra den behandlede overflade inden for 10 min.). Identificér og begrund tydeligt alle metodeændringer i testprotokollen. For flydende produkter eller sprayprodukter, der indeholder flygtige aktive ingredienser, hvor produktet påføres en hård, ikke-porøs overflade, kan den maksimale kontakttid bestemmes ved visuel inspektion af fordampningen over den foreslåede kontaktperiode." Endnu en gang indikerer dette udsagn klart en forventning om en våd kontakttid.
PDA teknisk rapport 70 [16] giver følgende ordlistedefinition: "Den minimale tid, som et afrensningsmiddell, desinfektionsmiddel eller sporicid skal efterlades i fuldstændig (våd) kontakt med den overflade, der skal behandles, for at være effektiv". Denne definition angiver klart en våd kontakttid.
Pharmig's Guide for Disinfectant Use [17] giver følgende tekst: "Hurtigere fordampning af desinfektionsmidlet kan forekomme på varme overflader, eller hvor den behandlede overflade er udsat for lav luftfugtighed eller høj luftstrøm, som nogle gange findes i renrumsdrift." Denne erklæring udleder en forventning om, at der kræves en våd kontakttid for at opnå effektivitet.
Fra ovenstående gennemgang af respekterede publikationer i den farmaceutiske industri er behovet for at kontakttiden skal være våd tydeligere.
Det er ikke utænkeligt, at der er en fortsættelse af desinfektionseffekten, efter at overfladen er synligt tør, da aktiviteten foregår på cellulært niveau. Det første trin af mikrobiel fjernelse er cellens optagelse af desinfektionsmidlets aktive ingrediens. Det kan derfor anses for, at der er to "tider" i spil under desinfektionen (figur 1).
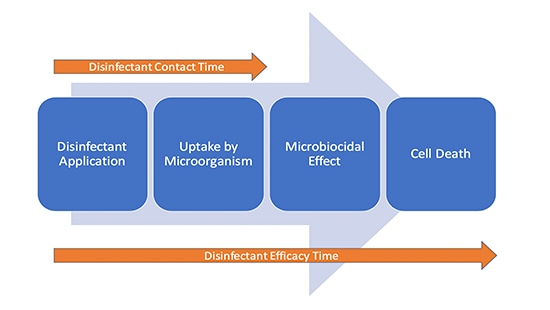
Konklusion
For at påvise effektivitet er en leverandør af desinfektionsmidleer forpligtet til at udføre standardtests under gentagelige forhold, udfra hvilke de vil definere en kontakttid. Denne kontakttid kan vise sig at være nyttig for slutbrugeren ved valg af det passende desinfektionsmiddel.
En slutbruger skal også validere desinfektionsmidlets effektivitet, afspejlende brugsbetingelserne på deres facilitet, herunder definition af en kontakttid, der anvendes i praksis.
De fleste farmaceutiske vejledningsorganisationer definerer kontakttid som en våd kontakttid.
Der er kun udgivet begrænsede undersøgelser for at undersøge desinfektionsmidlets ydeevne efter at overflader var synligt tørre. Det er også umuligt at måle i praksis, da brugeren ikke kan observere celledød som slutpunkt.
For at lette slutbrugertests, der er repræsentative for deres anlægsforhold, opfordres de til at måle den tid, det tager for desinfektionsmidler at fordampe, når de påføres ved hjælp af rutineteknikker (påsmøring/mopping) og bruge denne kontakttid til laboratorieundersøgelser.
Referencer:
- Forordning (Eu) nr. 528/2012 af Europa-Parlamentet og Rådet af 22. maj 2012 vedrørende tilgængeliggørelse på markedet og brug af biocidholdige produkter
- Titel 40 i Code of Federal Regulations (40 CFR) Underkapitel E Pesticid Programs Parts 150-189
- Vejledning for industrien fra FDA (USA's fødevare- og lægemiddelforvaltning) – sterile lægemiddelprodukter produceret ved aseptisk behandling, nuværende god fremstillingspraksis (2004)
- EudraLex bind 4 EU-retningslinjer for god fremstillingspraksis for lægemidler til human og veterinær brug Bilag 1 Fremstilling af sterile medicinske produkter (Udkast v.12, udgivet februar 2020)
- EN 14885:2018 Kemiske desinfektionsmidler og antiseptika. Anvendelse af europæiske standarder for kemiske desinfektionsmidler og antiseptika
- EPA Product Performance Test Guideline, OCSPP 810.2100, Sterilanter, Sporicider og Dekontaminanter, Vejledning til Effektivitetstest, [EPA 712-C-17 -003]
- United States Pharmacopoeia (USP) kapitel 1072 Desinfektionsmidler og antiseptika
- Code of Federal Regulations CFR Titel 21 - Fødevarer og lægemidler: Del 1 til 1499
- BILLEDGUIDE TIL GOD FREMSTILLINGSPRAKSIS FOR MEDICINSKE PRODUKTER – BILAG PE 009-14
- ISO 14644 Del 5 Renrum og tilknyttede kontrollerede miljøer – Del 5: Drift 2004
- Royal Pharmaceutical Society. Kvalitetssikring af aseptiske præparationstjenester: Standarder. Del A 5. udgave 2016
- DA 16615 Kemiske desinfektionsmidler og antiseptiske midler – Kvantitativ testmetode til evaluering af bakteriedræbende og gærdræbende aktivitet på ikke-porøse overflader med mekanisk virkning ved brug af servietter i det medicinske område (4-felttest) – Testmetode og krav (fase 2, trin 2)
- Pharmaceutical and Healthcare Sciences Society (PHSS) Technical Monograph 20 Karakterisering af biokontaminering, kontrol, overvågning og afvigelseshåndtering i kontrollerede / GMP-klassificerede områder
- Retningslinjer fra Center for Disease Control and Prevention (CDC) for desinfektion og sterilisering i sundhedsfaciliteter (2008)
- Product Performance Test Guideline, OCSPP 810.2000, Generelle overvejelser for testning af antimikrobielle pesticider i folkesundheden, Vejledning om effektivitetstestning, [EPA 712-C-17-002]
- Parenteral Drug Association (PDA) teknisk rapport nr. 70. Grundlæggende om rengørings- og desinfektionsprogrammer for aseptiske produktionsfaciliteter (2015).
- Pharmig Guide til desinfektionsmidler og deres anvendelse i medicinalindustrien (2017)
- West AM, Teska, PJ, Oliver HF; Der er ingen yderligere bakteriedræbende virkning af miljøbeskyttelsesagenturets registrerede desinficerende servietter efter overfladetørring eller efter kontakttid angivet på etiketten. Am J Infect Control 2019; 47: 27-32



